Introdução à Química/Evolução do modelo atômico: mudanças entre as edições
| Linha 97: | Linha 97: | ||
* Os Isóbaros são átomos que possuem o número de massa | * Os Isóbaros são átomos que possuem o número de massa | ||
* Através da radioatividade alguns átomos atuam como emissores de radiação nuclear, esta constitui a base do uso da energia atômica. | * Através da radioatividade alguns átomos atuam como emissores de radiação nuclear, esta constitui a base do uso da energia atômica. | ||
{{AutoCat}} | |||
Edição das 22h37min de 20 de maio de 2014
Os atomistas na Grécia antiga
A teoria atomista foi desenvolvida no século V a.C. por Leucipo de Mileto e seu discípulo Demócrito de Abdera que conciliou as constantes mudanças postuladas por Heráclito com a unidade e imutabilidade do ser propostas por Parmênides.
Demócrito postulava que a realidade se compõe de partículas indivisíveis ou "átomos" de natureza idêntica e do vácuo ou não-ente e que estes existem desde a eternidade em mútua interação dando origem ao movimento.
Segundo Demócrito, os átomos por si só apresentam as propriedades de tamanho, forma, impenetrabilidade e movimento, dando lugar, por meio de choques entre si, a corpos visíveis. Além disso, ao contrário dos corpos macroscópicos, os átomos não podem interpenetrar-se nem dividir-se, sendo as mudanças observadas em certos fenômenos químicos e físicos atribuídas pelos atomistas gregos a associações e dissociações de átomos. Nesse sentido, o sabor salgado dos alimentos era explicado pela disposição irregular de átomos grandes e pontiagudos.
O modelo de Dalton
O professor da universidade inglesa New College de Manchester, John Dalton (1766 - 1844) foi o criador da primeira teoria atômica moderna na passagem do século XVIII para o século XIX. Dalton é bastante lembrado pela famosa Lei de Dalton, a lei das pressões parciais e pelo daltonismo, o nome que se dá à incapacidade de distinguir as cores, assunto que ele estudou e mal de que sofria. Em 1803 Dalton publicou o trabalho Absorption of Gases by Water and Other Liquids, (Absorção de gases pela água e outros líquidos), neste delineou os princípios de seu modelo atômico.
Segundo Dalton:
- Átomos de elementos diferentes possuem propriedades diferentes entre si.
- Átomos de um mesmo elemento possuem propriedades iguais e de peso invariável.
- Átomos são partículas reais, indivisíveis e descontínuas formadoras da matéria.
- Nas reações químicas, os átomos permanecem inalterados.
- Na formação dos compostos, os átomos entram em proporções numéricas fixas 1:1, 1:2, 1:3, 2:3, 2:5 etc.
- O peso total de um composto é igual à soma dos pesos dos átomos dos elementos que o constituem.
Em 1808, Dalton propôs a teoria do modelo atômico, onde o átomo é uma minúscula esfera maciça, impenetrável, indestrutível e indivisível. Todos os átomos de um mesmo elemento químico são idênticos. Seu modelo atômico foi apelidado de "modelo atômico da bola de bilhar".
Em 1810 foi publicada a obra New System of Chemical Philosophy (Novo sistema de filosofia química), nesse trabalho, haviam teses que provavam suas observações, como a lei das pressões parciais, chamada de Lei de Dalton, entre outras relativas à constituição da matéria.
O modelo de John Thomson
Em 1897, Joseph John Thomson formulou a teoria segundo a qual a matéria, independente de suas propriedades, contém partículas de massa muito menores que o átomo do hidrogênio. Inicialmente denominou-as de corpúsculos, depois conhecidas como elétrons.
A demonstração se deu ao comprovar a existência daqueles corpúsculos nos raios catódicos disparados na ampola de crookes (um tubo que continha vácuo), depois da passagem da corrente elétrica.
Através de suas experiências, Thomson concluiu que a matéria era formada por um modelo atômico diferente do modelo atômico de Dalton: uma esfera de carga positiva continha corpúsculos (elétrons) de carga negativa distribuídos uniformemente à semelhança de um pudim de passas.
O "modelo atômico do pudim com passas", substituiu então ao "modelo da bola de bilhar", mas não eliminou totalmente as deduções de Dalton, apenas foram acrescentadas mais informações. Grande parte das teorias de Thomsom estão em sua obra Conduction of Electricity Through Gases (1903; Condução de eletricidade através dos gases).
O modelo atômico de Rutherford
Ernest Rutherford (1871 - 1937) foi premiado com o Prêmio Nobel da Química em 1908 pelas suas investigações sobre a desintegração dos elementos e a química das substâncias radioativas. Dirigiu o Laboratório Cavendish desde 1919 até à sua morte. Pode dizer-se que Rutherford foi o fundador da Física Nuclear. Distinguiu os raios alfa e beta e introduziu o conceito de núcleo atômico.
Bombardeando uma chapa metálica com partículas alfa, Rutherford percebeu que apenas uma pequena fração dessas sofria desvio de trajetória, com isto concluiu que as partículas que não se desviavam não encontravam no metal obstáculo que causasse a deflexão de sua trajetória; desta forma criou um modelo atômico no qual os elétrons giravam em torno do núcleo atômico, que considerou a região central do átomo onde havia a maior parte da massa atômica.
O modelo se baseava em órbitas eletrônicas, isto é, comparáveis à um sistema planetário, Rutherford chegou à conclusão que a maior parte do átomo se encontra vazia, estando praticamente a totalidade de sua massa no núcleo, este sendo em torno de 10.000 vezes menor que o átomo.
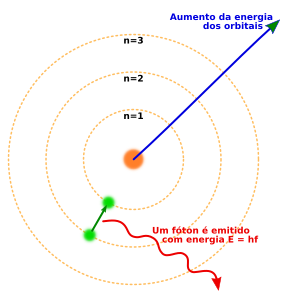
O modelo de Niels Bohr
A teoria orbital de Rutherford encontrou uma dificuldade teórica resolvida por Niels Bohr: no momento em que temos uma carga elétrica negativa composta pelos elétrons girando ao redor de um núcleo de carga positiva, este movimento gera uma perda de energia devido a emissão de radiação constante. Num dado momento, os elétrons deveriam se aproximar do núcleo num movimento em espiral até cair sobre ele.
Em 1911, Niels Bohr publicou uma tese que demonstrava o comportamento eletrônico dos metais. Na mesma época, foi trabalhar com Ernest Rutherford em Manchester, Inglaterra. Lá obteve os dados precisos do modelo atômico, que iriam lhe ajudar posteriormente.
Em 1913, observando as dificuldades do modelo de Rutherford, Bohr intensificou suas pesquisas visando uma solução teórica.
Em 1916, Niels Bohr retornou para Copenhague para atuar como professor de física. Continuando suas pesquisas sobre o modelo atômico de Rutherford.
Em 1920, nomeado diretor do Instituto de Física Teórica, Bohr acabou desenvolvendo um modelo atômico que unificava a teoria atômica de Rutherford e a teoria da mecânica quântica de Max Planck.
Sua teoria consistia que ao girar em torno de um núcleo central, os elétrons deveriam girar em órbitas específicas com níveis energéticos bem definidos. Que poderia haver a emissão ou absorção de pacotes discretos de energia chamados de quanta ao mudar de órbita.
Realizando estudos nos elementos químicos com mais de dois elétrons, concluiu que se tratava de uma organização bem definida em camadas. Descobriu ainda que as propriedades químicas dos elementos eram determinadas pela camada mais externa.
Bohr enunciou o princípio da complementaridade, segundo o qual um fenômeno físico deve ser observado a partir de dois pontos de vista diferentes e não excludentes. Observou que existiam paradoxos onde poderia haver o comportamento de onda e de partícula dos elétrons, dependendo do ponto de vista.
Essa teoria acabou por se transformar na hipótese proposta por Louis Broglie (Louis Victor Pierre Raymond, sétimo duque de Broglie) onde todo corpúsculo atômico pode comportar-se de duas formas, como onda e como partícula.
O modelo atômico atual resumido
Erwin Schrodinger, Louis Victor de Broglie e Werner Heisenberg, reunindo os conhecimentos de seus predecessores e contemporâneos, acabaram por desenvolver uma nova teoria do modelo atômico, além de postular uma nova visão, chamada de mecânica ondulatória.
Fundamentada na hipótese proposta por Broglie onde todo corpúsculo atômico pode comportar-se como onda e como partícula, Heisenberg, em 1925, postulou o princípio da incerteza.
A idéia de órbita eletrônica acabou por ficar desconexa, sendo substituída pelo conceito de probabilidade de se encontrar num instante qualquer um dado elétron numa determinada região do espaço.
O átomo deixou de ser indivisível como acreditavam filósofos gregos antigos. O modelo atômico portanto, passou a se constituir na verdade, de uma estrutura complexa.
- É sabido que os elétrons possuem carga negativa, massa muito pequena e que se movem em órbitas ao redor do núcleo atômico.
- O núcleo atômico é situado no centro do átomo e constituído por prótons que são partículas de carga positiva, cuja massa é aproximadamente 1.837 vezes superior a massa do elétron, e por nêutrons, partículas sem carga e com massa ligeiramente superior à dos prótons.
- O átomo é eletricamente neutro, por possuir números iguais de elétrons e prótons.
- O número de prótons no átomo se chama número atômico, este valor é utilizado para estabelecer o lugar de um determinado elemento na tabela periódica.
- A tabela periódica é uma ordenação sistemática dos elementos químicos conhecidos.
- Cada elemento se caracteriza por possuir um número de elétrons que se distribuem nos diferentes níveis de energia do átomo correspondente.
- Os níveis energéticos ou camadas, são denominados pelos símbolos K, L, M, N, O, P e Q.
- Cada camada possui uma quantidade fixa de elétrons. A camada mais próxima do núcleo K, comporta somente dois elétrons; a camada L, imediatamente posterior, oito, e assim sucessivamente.
- Os elétrons da última camada (mais afastados do núcleo) são responsáveis pelo comportamento químico do elemento, por isso são denominados elétrons de valência.
- O número de massa é equivalente à soma do número de prótons e nêutrons presentes no núcleo.
- O átomo pode perder elétrons, carregando-se positivamente, é chamado de íon positivo (cátion).
- Ao receber elétrons, o átomo se torna negativo, sendo chamado íon negativo (ânion).
- O deslocamento dos elétrons provoca uma corrente elétrica, que dá origem a todos os fenômenos relacionados à eletricidade e ao magnetismo.
- No núcleo do átomo existem duas forças de interação a chamada interação nuclear forte[[, responsável pela coesão do núcleo, e a interação nuclear fraca, ou força forte e força fraca respectivamente.
- As forças de interação nuclear são responsáveis pelo comportamento do átomo quase em sua totalidade.
- As propriedades físico-químicas de um determinado elemento são predominantemente dadas pela sua configuração eletrônica, principalmente pela estrutura da última camada, ou camada de valência.
- As propriedades que são atribuídas aos elementos na tabela, se repetem ciclicamente, por isso se denominou como tabela periódica dos elementos.
- Os isótopos são átomos de um mesmo elemento com mesmo número de prótons, mas quantidade diferente de nêutrons.
- Os isótonos são átomos que possuem o mesmo número de nêutrons
- Os Isóbaros são átomos que possuem o número de massa
- Através da radioatividade alguns átomos atuam como emissores de radiação nuclear, esta constitui a base do uso da energia atômica.